Microorganismos benéficos en la agricultura
Actividad 1: Práctica en Campo
¿Qué son?
Captura de microorganismos benéficos en suelo virgen
Materiales:
- Recipiente
- Arroz
- Ligas
- Tul
Procedimiento:
- En un recipiente (tarrina oscura) se agregó una porción de arroz precocida que funcionó como trampa.
- Se colocó un pedazo de tul a modo de tapa y con las ligas se aseguró que el tul no se mueva para evitar derrames.
- Se seleccionó la zona para colocar las trampas; este debe ser un lugar donde no exista la intervención del hombre (jardín, cultivos, etc.).
- Con cuidado se debe colocar la trampa donde el tul esté en contacto con el suelo.
- Se esperó aproximadamente 10 días para recolectar la trampa.
- Análisis de fertilidad microbiana del suelo.

Nota: A. Identificación del suelo virgen (Casahuala). B. Identificación de la zona. C. Colocación de trampas bajo un árbol de papel. D. Trampa colocada bajo tierra y con un identificador
Siembra en medio sólido
Los medios solidos son utilizados para la multiplicación de microorganismos benéficos.
Materiales:
- Balde de 20 litros con tapa
- Polvillo de arroz (10-15 libras)
- Hojarasca o mantillo (10-15 libras)
- Agua de fuente pura (10 litros)
- Melaza (1 litro)
- Trampa con microorganismos benéficos
Procedimiento:
- Se desinfectó el balde para evitar contaminación con alcohol antiséptico.
- Se diluyó 750 mL de melaza en 1 litro de agua.
- Primeramente se agregó un poco de polvillo de arroz junto con hojarasca y se mezcló.
- Se realizó un agujero en forma de volcán en donde se vertió la trampa con los microorganismos benéficos y se mezcló.
- Se agregó continuamente polvillo de arroz, hojarasca, melaza y agua hasta llenar un poco más de las dos tercias partes del volumen del balde.
- Se mezcló hasta tener una masa homogénea, donde la textura no sea seca ni húmeda.
- Se dejó reposar la mezcla dentro del balde con tapa aproximadamente 8 días.
Nota: A. Materiales para la siembra en Medio Sólido B. Mezcla de los materiales secos y líquidos en el valde. C. Resultados del medio solido
Siembra de medio liquido
Materiales:
- Balde de color
- Funda de tela
- Melaza
- Agua sin cloro
- Manguera
- Botella
- Mezcla del medio solido
Procedimiento:
- Se desinfectó el balde para evitar contaminación con alcohol antiséptico.
- Se diluyó 750 mL de melaza en 1 litro de agua.
- Con el resultado del medio sólido, parte de su contenido fue colocado en una funda de tela o media nylon.
- Se coloco la funda de tela en el valde suspendido, donde este flotando en el medio liquido.
- En la tapa del balde se colocó la manguera y se conectó a una botella vacía.
- Se selló el alrededor tanto de entrada y salida de la manguera para evitar fugas simulando un biodigestor.
Nota: A. Mezcla de agua y melaza B. suspensión del medio sólido. C. colocación del medio liquido en el balde. D. Cierre del balde con tapa
Actividad 2: Práctica de Laboratorio
Práctica de Laboratorio
Para analizar los microorganismos presentes en las muestras de suelo tomadas, estas se prepararon y sembraron en medio PDA y PCA. El agar PCA es un medio recomendado para la enumeración estandarizada de bacterias aerobias en agua, productos lácteos y alimentos, cosméticos o productos farmacéuticos; mientras que el medio PDA se emplea para cultivar hongos (Reasoner & Geldreich, 1985).
1. Pesar y disolver peptona de caseína (5 gramos), el extracto de levadura (2.5 gramos) y la glucosa (1 gramos) en un litro de agua destilada.
2. Agregar 15 gramos de agar al medio y mezclar bien.
3. Calentar el medio mientras se agita suavemente hasta que el agar se disuelva completamente.
4. Ajustar el pH del medio a 7.2 ± 0.2, si es necesario.
5. Autoclavar el medio a 121 °C durante 20 minutos.
6. Transcurrido el tiempo, enfriar el medio a alrededor de 45-50 °C.
7. Vertir el medio de cultivo en placas de Petri estériles.
8. Dejar que se solidifique el medio.
9. Almacenar las placas de Petri a 2-8 °C hasta que sea necesario su uso.
(Microbiologie Clinique, 2022)
· Preparación de agua peptonada
1. Pesar 10 gramos de peptona y disolverla en 1 litro de agua destilada.
2. Autoclavar la solución a 121 °C durante 20 minutos.
3. Transcurrido el tiempo, se deja enfriar el agua peptonada a temperatura ambiente.
4. Almacenar el agua peptonada en recipientes estériles hasta que sea necesario su uso.
Preparación de agua peptonada
1. Pesar 10 gramos de peptona y disolverla en 1 litro de agua destilada.
2. Autoclavar la solución a 121 °C durante 20 minutos.
3. Transcurrido el tiempo, se deja enfriar el agua peptonada a temperatura ambiente.
4. Almacenar el agua peptonada en recipientes estériles hasta que sea necesario su uso.
Biofertilizantes
Los biofertilizantes son preparaciones biológicas que contienen microorganismos beneficiosos que promueven el crecimiento de las plantas al mejorar la adquisición de nutrientes, se pueden aplicar a semillas o suelo, y pueden mejorar la disponibilidad de nutrientes, la absorción de agua y las tasas fotosintéticas en las plantas (Dasgupta et al, 2021).
Es en este contexto donde se destacan las tecnologías y prácticas agrícolas sostenibles, las cuales pueden convertirse en grandes aliadas para sostener nuestra producción agrícola. Estas innovaciones, basadas en principios respetuosos con el medio ambiente, nos permiten aprovechar al máximo los recursos disponibles, minimizando los impactos negativos en el entorno y preservando la calidad de los suelos, el agua y la biodiversidad., pues estos bioinsumos también ayudan a controlar las enfermedades de las plantas y pueden mejorar la sostenibilidad del suelo (Gautam et al, 2021).
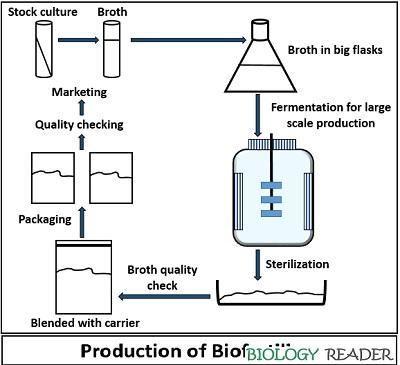
Elaboración de biofertilizantes
Para la práctica de laboratorio se elaboraron trampas de arroz medianamente cocido, que fueron colocadas en tierra virgen para atrapar microorganismos benéficos. Estas trampas fueron recolectadas después de una semana e inoculadas en medio sólido y posteriormente en medio líquido, como se vio en apartados anteriores.
No obstante, el proceso de producción de biofertilizantes a nivel industrial consta de varios pasos importantes:
1. Selección de cepas: Se realiza una cuidadosa selección de cepas de microorganismos que sean beneficiosas para las plantas y el suelo. Estas cepas pueden incluir bacterias fijadoras de nitrógeno, hongos micorrícicos arbusculares u otros microorganismos promotores del crecimiento vegetal.
2. Cultivo y multiplicación de cepas: Las cepas seleccionadas se cultivan en medios de cultivo adecuados, proporcionando las condiciones óptimas de temperatura, pH y nutrientes para su crecimiento y multiplicación. Este proceso puede llevarse a cabo en laboratorios o instalaciones especializadas.
3. Preparación del inóculo: Una vez que las cepas han crecido lo suficiente, se prepara el inóculo. El inóculo es una forma concentrada de las cepas que se utilizará para inocular las semillas o el suelo. Puede estar compuesto por una suspensión líquida de las cepas o por una mezcla con algún material inerte como vermiculita.
4. Inoculación de semillas o suelo: El inóculo preparado se aplica en las semillas o se distribuye sobre el suelo en el momento de la siembra. Esto asegura que los microorganismos benéficos estén en contacto directo con las raíces de las plantas y puedan establecer una relación simbiótica.
5. Mantenimiento, almacenamiento y empaque: Es importante mantener las cepas en condiciones adecuadas de almacenamiento para preservar su viabilidad y actividad biológica. Se pueden utilizar diferentes técnicas de conservación, como la liofilización o la refrigeración, para prolongar la vida útil de los biofertilizantes. Asimismo, se realiza el empaque adecuado para mantener la calidad del producto y facilitar su distribución.
6. Cumplimiento de estándares de calidad: Durante todo el proceso de producción, es fundamental garantizar que los biofertilizantes cumplan con los estándares de calidad establecidos por las autoridades competentes. Esto implica realizar análisis y pruebas de laboratorio para evaluar la concentración de microorganismos, la viabilidad, la pureza y la eficacia del producto final.
(Supriya, 2020)
Práctica de Laboratorio
Se llevaron a cabo preparaciones de las muestras de bioinsumo para su posterior análisis de los microorganismos presentes. Estas muestras se sembraron en medios de cultivo conocidos como PDA y PCA. El agar PCA es especialmente utilizado para la enumeración precisa de bacterias aerobias en diversos productos como agua, lácteos, alimentos, cosméticos y productos farmacéuticos. Por otro lado, el medio PDA se emplea específicamente para el cultivo de hongos. (Reasoner & Geldreich, 1985).
Preparación de la muestra
La muestra fue colocada en un vaso de precipitación, previamente desinfectado, de tal manera que pueda ser de fácil acceso para la realización de las diluciones requeridas para la siembra.
Diluciones seriadas
Con las mismas condiciones asépticas, con una micropipeta se pipeteó 1 mL del bioinsumo y se colocó en un tubo de ensayo con 9 mL de agua peptonada; obteniéndose en el tubo una dilución de 10-1 y se desechó la punta.
A continuación, del tubo con dilución 10-1 se pipeteó 1 mL de la solución y se colocó en otro tubo de ensayo con 9 mL de agua peptonada, obteniéndose una dilución de 10-2 y se desechó la punta.
Se repitió el procedimiento hasta obtener un tuvo de ensayo con una dilución de 10-5.
Siembra microbiológica de la muestra de suelo
Se llevó a cabo la siembra de 1 mL del tubo en una placa de cultivo PCA después de diluirlo en una proporción de 10-5. Este procedimiento se realizó en una cámara de flujo laminar bajo condiciones asépticas, utilizando un mechero de alcohol para garantizar la esterilidad.
Se utilizó una pipeta para tomar 1 mL del tubo y se colocó en la parte superior del agar de la placa.
Utilizando un asa previamente desinfectada y esterilizada, se realizó una siembra con una estría simple, extendiendo el cultivo hasta el centro del agar.
Luego, se esterilizó nuevamente el asa y se cubrió la caja de Petri, la cual fue etiquetada posteriormente.
Incubación de la placa
Luego de la siembra, la placa con medio PCA fue incubadas a 37 °C y la placa con medio PDA fue incubada a 27.5°C durante 6 días.
· Resultados después de la incubación
·
Se utilizan principalmente microorganismos como bacterias, hongos y micorrizas de diferentes géneros como Bacillus, Lactobacillus, Azotobacter, Pseudomonas, bacterias fotosintéticas, Trichoderma sp., Glomus sp., Gigaspora sp., Pezizella sp., y levaduras, que poseen capacidades beneficiosas como la fijación de nitrógeno, la solubilización de fosfatos, zinc, hierro y potasio, así como la producción de fitohormonas y enzimas celulolíticas. Estos microorganismos pueden desbloquear el fósforo del suelo y transferir el nitrógeno a la planta, lo que se traduce en plantas más fuertes y productivas (Khan et al, 2023).
Actividad 3: Práctica de Laboratorio
Análisis de Fertilidad Microbiana del Suelo
Las muestras de suelo tomadas para su posterior análisis microbiológico fueron tomadas en Querochaca, provincia de Tungurahua. Dichas muestras fueron tomadas con barrenos y homogeneizadas en un balde, y que fueron refrigeradas en fundas ziploc hasta que llegara el día del análisis en laboratorio.
Las muestras de suelo fueron tomadas alrededor de cultivos de crisantemos y gladiolos. Cada cultivo tiene su interacción microbiana con microorganismos que pueden ser tanto benéficos como patógenos. A continuación, se expone acerca de la dinámica microbiana con este tipo de cultivos.Crisantemos
El crisantemo es una planta ornamental originaria del noreste de Europa y Asia que posee un alto valor de exportación y demanda a nivel mundial debido a su uso en té. El cultivo continuo de crisantemos cortados ha demostrado tener impactos negativos en las propiedades físicas, químicas y microbiológicas del suelo (Li et al., 2023). Se ha estudiado la predominancia microbiana del suelo en cultivos de crisantemo dependiendo del tipo de cultivo que se emplea.
Es preciso decir que la comunidad microbiana de la rizosfera juega un papel importante en el mantenimiento del crecimiento saludable de las plantas. Sin embargo, en condiciones de monocultivo de estas plantas, se ha determinado la presencia de varios fitopatógenos que afectan significativamente la fertilidad y calidad de los suelos para este tipo de cultivos (Wang et al., 2022).
Las enzimas del suelo se consideran indicadores clave para evaluar la fertilidad y calidad del suelo. En el caso de suelo sometido a un cultivo continuo a largo plazo, la disminución en las actividades de enzimas como la β-glucosidasa y fosfatasa alcalina podría estar relacionada con la reducción en la diversidad bacteriana y alteraciones en la comunidad bacteriana. Se ha comprobado que el cultivo continuo inhibe la expresión de genes funcionales asociados a actividades enzimáticas, lo cual conduce a una disminución en dichas actividades (Li et al., 2023). La abundancia de genes relacionados con el metabolismo del nitrógeno y el azufre y la lisis de quitina se reduce en la rizósfera del crisantemo. Los taxones fúngicos patógenos de crisantemo en la rizósfera están dados por: Acremonium, Plectosphaerellaceae, Fusarium y Cladosporium (Wang et al., 2022).
El análisis de los hongos filamentosos aislados de la superficie de las hojas de crisantemo indio (Chrysanthemum indicum L.) muestra un predominio de los géneros Aspergillus y géneros de Penicillium (Lipsa et al., 2015).
Gladiolos
El gladiolo es una flor cortada bulbosa comercialmente importante que crece por sus atractivas espigas multicolores. Estudios han demostrado que los gladiolos tienen un buen crecimiento cuando están en presencia de Rhizobium, Azotobacter Azospirillum, observándose, además, una mejora significativa en diferentes rasgos vegetativos y florales, composición química de las hojas del gladiolo, y un aumento significativo en el contenido total de clorofila, contenido de proteínas, azúcares solubles totales y acumulación de nutrientes (N, P y K) en las hojas por acción de Azosprillum seguido de Azotobacter. Azospirillum provoca un efecto significativo en la altura de la planta debido a que mejora la absorción de macro y micronutrientes de las plantas.
(Qasim et al., 2014)
Alrededor de los cultivos de gladiolos, se han identificado diferentes tipos de Enterobacteriaceae, que son un gran grupo de bacilos gramnegativos, incluidos E. coli, Enterobacter, Klebsiella, Proteus, Serratia, Citrobacter y Pseudomonas. Se identificó una variedad de bacterias grampositivas, incluyendo Staphylococcus aureus, Sapropheticus, Streptococcus, Bacillus cereus y Actinomyces (Langroudi et al., 2020).
Práctica de Laboratorio
La preparación de medios de cultivo y agua peptonada se mencionó en la actividad 2, los cuales también se utilizarán en la actividad 3.
Preparación de la muestraComo primer paso, se tamizaron las muestras de suelo previamente homogeneizadas. Para ello, en un recipiente grande y con un colador, se vertieron las muestras de suelo para tamizarlas.
Seguidamente, se procedió con el pesado de la muestra de suelo. Para ello, la balanza debió estar previamente tarada para tener un peso correcto.
Con una espátula, se tomó una pequeña cantidad de suelo para tener un peso de 5 gramos. La muestra de suelo fue colocada en papel aluminio.
Posteriormente, se vertió la muestra pesada en una botella con tapa azul que contenía 45 mL de agua peptonada. Este paso fue ejecutado en un ambiente aséptico con un mechero de alcohol en el área de trabajo.
Se agitó constantemente la botella hasta que la tierra se disolviera completamente.
Diluciones seriadas
Con las mismas condiciones asépticas, con una micropipeta se pipeteó 1 mL del agua peptonada con muestra de tierra y se colocó en un tubo de ensayo con 9 mL de agua peptonada; obteniéndose en el tubo una dilución de 10-2 y se desechó la punta.
A continuación, del tubo con dilución 10-2 se pipeteó 1 mL de la solución y se colocó en otro tubo de ensayo con 9 mL de agua peptonada, obteniéndose una dilución de 10-3 y se desechó la punta.
Se repitió el procedimiento hasta obtener un tuvo de ensayo con una dilución de 10-5.
Siembra microbiológica de la muestra de suelo
Con la dilución de 10-5 se procedió a sembrar 1 mL del tubo en una placa con medio de cultivo PCA. Este paso se realizó en una cámara de flujo laminar en condiciones asépticas proporcionadas con un mechero de alcohol.
Se introdujo un asa previamente desinfectada y esterilizada en el tubo para recoger aproximadamente 1 mL de la solución y se dispensó en la parte superior del agar; se realizó una siembra con estría simple, hasta la parte central del agar.
Se volvió a esterilizar el asa y se tapó la caja Petri que fue posteriormente rotulada. Dicha metodología se aplicó también para realizar la siembra en medio PDA.
Incubación de la placa
Luego de la siembra, la placa con medio PCA fue incubadas a 37 °C y la placa con medio PDA fue incubada a 27.5°C durante 6 días.
Resultados después de la incubación
Actividad 4: Debate
·
Bibliografía:
Atkinson, C. F., Jones, D. D., & Gauthier, J. J. (1996). Biodegradability and microbial activities during composting of poultry litter. Poultry Science, 75(5), 608-617. https://www.sciencedirect.com/science/article/pii/S0032579119425194
Castillo, F. R.-R. (2005). Biotecnología
Ambiental - Ciclo Biogeoquímicos III - Ciclos del nitrógeno, azufre, hierro y
otros elementos. Madrid - España: Editorial Tébar, S.L.
Dasgupta, D., Kumar, K., Miglani, R., Mishra, R., Panda, A. K., & Bisht, S. S. (2021). Microbial biofertilizers: Recent trends and future outlook. In S. De Mandal & A. K. Passari (Eds.), Recent Advancement in Microbial Biotechnology (pp. 1–26). Elsevier.
Gautam, K., Sirohi, C., Singh, N. R., Thakur, Y., Jatav, S. S., Rana, K., Chitara, M., Meena, R. P., Singh, A. K., & Parihar, M. (2021). Microbial biofertilizer: Types, applications, and current challenges for sustainable agricultural production. In A. Rakshit, V. S. Meena, M. Parihar, H. B. Singh, & A. K. Singh (Eds.), Biofertilizers (pp. 3–19). Elsevier.
Hétier, J.-M., & López-Hernández,
D. (2015). Aspectos biogeoquimicos de los ciclos de nutritientes en
agroecosistemas. https://horizon.documentation.ird.fr/exl-doc/pleins_textes/divers15-12/010065643.pdf
Higa, T., & Parr, J. F. (2013). Microorganismos Benéficos y efectivos para una agricultura y medio ambiente sostenibles. Maryland (USA): Centro internacional de Investigación de Agricultura Natural, Departamento de Agricultura de los Estados Unidos, 13(2), 128-135
Khan, A., Panthari, D., Sharma, R. S.,
Punetha, A., Singh, A. V., & Upadhayay, V. K. (2023). Biofertilizers: a
microbial-assisted strategy to improve plant growth and soil health. In S.
Chandra Pandey, V. Pande, D. Sati, & M. Samant (Eds.), Advanced
Microbial Techniques in Agriculture, Environment, and Health Management (pp.
97–118). Elsevier.
Langroudi, M. E., Hashemabadi, D., KalateJari, S., & Asadpour, L. (2020). Effects of silver nanoparticles, chemical treatments and herbal essential oils on the vase life of cut alstroemeria (Alstroemeria ‘Summer Sky’) flowers. The Journal of Horticultural Science and Biotechnology, 95(2), 175-182. https://www.tandfonline.com/doi/abs/10.1080/14620316.2019.1657786
Li, J., Cheng, X., Chu, G., Hu, B., & Tao, R. (2023). Continuous cropping of cut chrysanthemum reduces rhizospheric soil bacterial community diversity and co-occurrence network complexity. Applied Soil Ecology, 185, 104801. https://www.sciencedirect.com/science/article/abs/pii/S0929139322004176
Lipșa, F. D., Bălău, A. M., & Ulea, E. (2015). Diversity of microbial communities in the phyllosphere of ornamental plants. https://repository.uaiasi.ro/xmlui/handle/20.500.12811/1962
Maderey, L., & Jiménez, A.
(2005). Principios de Hidrogeografía. Estudio Del Ciclo Hidrológico.
Universidad Autónoma de México.
Madigan, M., Martinko, J., Bender, K.,
Buckley, D., & Stahl, D. (2015). Brock Biología de los
Microorganismos (14a Edición). PEARSON EDUCACIÓN, S.A.
Microbiologie Clinique. (2022). PCA - Agar Plate Count. Microbiologie Clinique. https://microbiologie-clinique.com/pca-agar-plate-count.html
Pérez-Guzmán, L., Bogner, K. R. &
Lower, B. H. (2010) Earth's Ferrous Wheel. Naturaleza
Educación Conocimiento 3( 10 ) :32
Qasim, M., Younis, A., Zahir, Z. A., Riaz, A., Raza, H., & Tariq, U. (2014). Microbial inoculation increases the nutrient uptake efficiency for quality production of Gladiolus grandiflorus. Pakistan Journal of Agricultural Sciences, 51(4). https://www.academia.edu/download/92110125/papers_5C2353.pdf
Reasoner, D. J., & Geldreich, E. (1985). A new medium for the enumeration and subculture of bacteria from potable water. Applied and environmental microbiology, 49(1), 1-7. https://journals.asm.org/doi/abs/10.1128/aem.49.1.1-7.1985
Supriya, N. (2020).
Biofertilizer production. Biology Reader.
https://biologyreader.com/biofertilizer-production.html
Tian, J., Ge, F., Zhang, D., Deng, S.,
& Liu, X. (2021). Roles of phosphate solubilizing microorganisms
from managing soil phosphorus deficiency to mediating biogeochemical
cycle. Biology, 10(2), 1–19. https://doi.org/10.3390/biology10020158
Valverde, T. V. (2005). Ecología y
medio ambiente - El movimiento de la materia: Ciclos biogeoquímicos. En
F. d.-U. México. México: Editorial Pearson Education.
Wang, T., Yang, K., Ma, Q., Jiang, X., Zhou, Y., Kong, D., ... & Ruan, Z. (2022). Rhizosphere microbial community diversity and function analysis of cut Chrysanthemum during continuous monocropping. Frontiers in Microbiology, 13. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8967409/
























No hay comentarios.:
Publicar un comentario